УДК 577.113.3
В.В.Власов, акад. РАН, В.Ф.Зарытова, д-р хим. наук, А.С.Левина, канд. хим. наук,
Институт биоорганической химии СО РАН, г. Новосибирск,
В.Н.Федоринин, канд. техн. наук,
Конструкторский технологический институт прикладной микроэлектроники СО РАН, г. Новосибирск
Рефрактометрические исследования кинетики гибридизации комплементарных олигонуклеотидов на поверхности ДНК-чипа
![]()
|
Приведены результаты исследований кинетики
гибридизации комплементарных олигонуклеотидов
на поверхности ДНК-чипа с использованием эллипсометрического
метода измерения. Представлена физико-химическая модель структуры чипа и
процесса, происходящего на его поверхности. |
Одно из перспективных направлений в медицинской диагностике инфекционных и генетических заболеваний связано с созданием тест-систем на основе твердотельных ДНК-чипов и с разработкой ДНК-сенсоров.
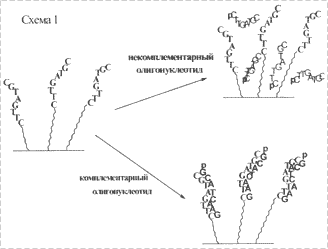
Работа ДНК-чипа основана на фундаментальном свойстве цепей ДНК образовывать прочные комплементарные комплексы. Детектируемая ДНК, находящаяся в растворе, может связываться с комплементарным ей фрагментом ДНК, иммобилизованным на поверхности (рис. 1).
|
|
|
Рис. 1. Схема гибридизации ДНК с комплементарным |
Проводимые в данной работе исследования кинетики процесса гибридизации и образования комплементарных дуплексов на поверхности ДНК-чипа преследуют цель построения физико-химической модели структуры и процесса, происходящего на поверхности ДНК-чипа. Решение данной задачи создает предпосылки к разработке математических методов определения количественных параметров и характеристик гибридизационного анализа.
Исследование кинетики процессов гибридизации на поверхности ДНК-чипа осуществлялось путем измерения рефрактометрической характеристики и параметров чувствительного слоя ДНК-чипа эллипсометрическим методом.
Физическими параметрами,
описывающими состояние чувствительного слоя, являются показатель преломления ![]() и толщина слоя
и толщина слоя ![]() . Показатель преломления слоя определяется через соотношение Лоренц-Лорентца и связан с молекулярной поляризуемостью
. Показатель преломления слоя определяется через соотношение Лоренц-Лорентца и связан с молекулярной поляризуемостью
![]() , количеством типов молекул и связей
, количеством типов молекул и связей ![]() в единице объема
в единице объема ![]() :
:
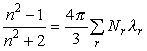 .
(1)
.
(1)
В общем случае процесс
гибридизации ![]() -олигонуклеотидов связан с
образованием на поверхности
-олигонуклеотидов связан с
образованием на поверхности ![]() -комплементарных дуплексов и
характеризуется изменением молекулярной поляризуемости
-комплементарных дуплексов и
характеризуется изменением молекулярной поляризуемости
![]() вновь образованного
комплекса. Данный процесс может быть представлен соотношением Лоренц-Лорентца в следующей форме:
вновь образованного
комплекса. Данный процесс может быть представлен соотношением Лоренц-Лорентца в следующей форме:
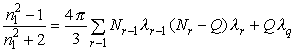 . (2)
. (2)
Изменение показателя
преломления ![]() , обусловленного процессами гибридизации, определяется
уравнением
, обусловленного процессами гибридизации, определяется
уравнением
![]() . (3)
. (3)
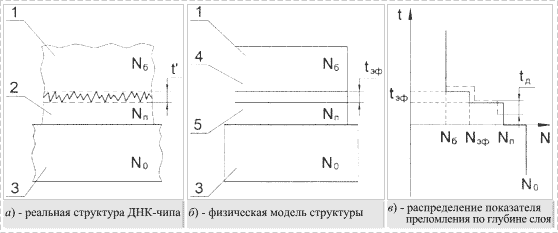
Априори предложена следующая физическая модель структуры ДНК-чипа
(рис. 2). Реальная структура чувствительного слоя, приведенная на
рис. 2,а, рассматривалась в виде двухслойной системы (рис. 2,б), где
нижний слой, граничащий с подложкой, имеет показатель преломления ![]() и толщину
и толщину ![]() , верхний переходный слой обладает некоторой эффективной
толщиной
, верхний переходный слой обладает некоторой эффективной
толщиной ![]() эф и
показателем преломления
эф и
показателем преломления ![]() эф,
эф, ![]() б
б![]() эф
эф![]() .
.
Предполагается, что процесс гибридизации фрагментов ДНК на поверхности
реальной структуры приведет к изменению эффективного показателя преломления и
толщины переходного слоя, а также к образованию диффузионного слоя толщиной ![]() д с показателем преломления
д с показателем преломления ![]() д
(рис. 2,в).
д
(рис. 2,в).
|
|
|
Рис. 2. Физическая модель структуры ДНК-чипа |
Практические результаты эксперимента интерпретировались в рамках данной модели.
Кинетика процессов гибридизации, происходящих на активной поверхности
ДНК-чипов, рассматривается в рамках основных положений теории адсорбции Ленгмюра. Согласно данной теории процесс адсорбции связан с
наличием на поверхности активных центров, на которых происходит адсорбция
молекул из жидкой фазы. Условие адсорбционного равновесия характеризуется
равенством скоростей адсорбции ![]() и десорбции
и десорбции ![]() .
.
Уравнения, определяющие скорости адсорбции и десорбции в зависимости от концентрации адсорбата в растворе, имеют вид
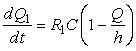 ;
; ![]() , (4)
, (4)
где ![]() ,
, ![]() – константы скорости;
– константы скорости; ![]() – количество
адсорбированных молекул;
– количество
адсорбированных молекул; ![]() – число активных
центров.
– число активных
центров.
Согласно теории Ленгмюра в условии адсорбционного равновесия зависимость
количества адсорбированных молекул ![]() от концентрации
от концентрации ![]() адсорбата
в растворе определяется соотношением вида
адсорбата
в растворе определяется соотношением вида
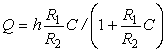 . (5)
. (5)
В случаях, когда скорость десорбции ![]() , количество адсорбированных молекул не зависит от
концентрации, а определяется числом активных центров в
дальнейшем определим число активных центров как емкость ДНК-чипа.
, количество адсорбированных молекул не зависит от
концентрации, а определяется числом активных центров в
дальнейшем определим число активных центров как емкость ДНК-чипа.
Кинетика адсорбционного
процесса характеризуется функцией ![]() и имеет вид
и имеет вид
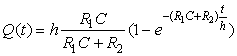 . (6)
. (6)
В условиях отсутствия
десорбции молекул с поверхности (![]() ) кинетическое уравнение (6) принимает вид
) кинетическое уравнение (6) принимает вид
![]() .
(7)
.
(7)
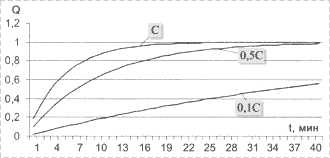
Кинетические кривые адсорбции при разных концентрациях представлены на рис. 3.
|
|
|
Рис.
3. Кинетические кривые адсорбции |
Концентрацию адсорбата в растворе можно определять
путем измерения времени процесса адсорбции до заполнения фиксированного уровня
активных центров ![]() .
.
Соотношение между концентрацией и временем регистрации имеет вид
![]() , (8)
, (8)
где ![]() – калибровочная
константа.
– калибровочная
константа.
Предел обнаружения в случае отсутствия десорбционных процессов будет определяться числом активных центров (емкостью ДНК-чипа) и ограничивается реальным временем измерения.
Методика эксперимента
Регистрация изменений оптических констант и параметров чувствительного слоя ДНК-чипа осуществлялась путем измерения состояния поляризации отраженной световой волны от границы раздела фаз иммобилизованный слой – буферный раствор в условии полного внутреннего отражения (ПВО).
Конструкция ДНК-чипа представляет собой призму, выполненную из стекла. На основание призмы методом электронно-лучевого напыления наносился защитный слой SiO2 толщиной 400 нм, на поверхности которого был иммобилизован слой олигонуклеотидов. Измерение осуществлялось эллипсометрическим датчиком.
Амплитуда коэффициентов отражения от границы раздела фаз при условии полного внутреннего отражения равна 1. Состояние поляризации излучения отраженной волны характеризуется разностью фаз между двумя ортогональными компонентами
![]() .
.
Эллипсометрический датчик имеет следующие технические характеристики:
Чувствительность к изменению фазы.......................................... ![]() °
°
Линейный диапазон измерений....................................................... ![]() °
°
Длина волны...................................................................................... 650 нм
Датчик обеспечивает регистрацию изменений
показателя преломления ![]() , изменение толщины переходного и диффузионных слоев на
уровне 0,5 нм.
, изменение толщины переходного и диффузионных слоев на
уровне 0,5 нм.
В экспериментах использовался способ иммобилизации олигонуклеотидов, разработанный в НИБХ СО РАН, который позволяет достигать плотности иммобилизации олигонуклеотидов 70 пмоль/мм2 на поверхности SiO2.
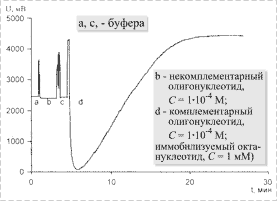
На рис. 4 представлена зависимость изменения показаний датчика во времени в случае чистого буфера (участки а, с) при добавлении некомплементарного (участок b) и комплементарного олигонуклеотида к октануклеотиду, иммобилизованному на поверхности SiO2.
Значительные изменения показаний датчика происходят лишь
при добавлении комплементарного октаметра,
способного связываться с исходным олигонуклеотидом с
образованием дуплекса. Концентрация олигонуклеотидов
в буфере составляла 1×10-4 М.
Масштаб показаний датчика ![]() при изменении на
1000 мВ соответствует изменению поляризации на 2°.
при изменении на
1000 мВ соответствует изменению поляризации на 2°.
Дуплекс разрушался горячей водой и олигонуклеотид, не связанный с поверхностью, удалялся. После чего проводилась повторная гибридизация.
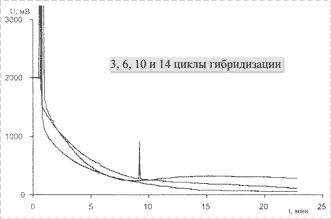
На рис. 5 приведены результаты многократной гибридизации на поверхности ДНК-чипа; существенных отличий в сигналах не наблюдалось.
В приведенных результатах зависимость показаний датчика от времени соответствует характеру экспоненциальной кривой.
|
|
|
|
Рис. 4. Изменение показаний сенсора |
Рис. 5. Изменение показаний сенсора при повторении гибридизации несколько раз на одной призме с иммобилизованным олигонуклеотидом |
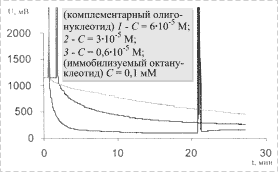
Исследованы зависимости кинетики протекания процесса гибридизации при различных концентрациях комплементарных олигонуклеотидов в растворе. Результаты исследований представлены на рис. 6.
Результаты данного эксперимента показывают, что при уменьшении концентрации комплементарного олигонуклеотида
время для достижения постоянного уровня сигнала увеличивается: если при
концентрации ![]() М насыщение достигается за 4-5 мин, то при концентрации
6×10-6 М
– уже более часа. Очевидно, что обнаружение меньших концентраций требует еще
большего времени. Результаты эксперимента согласуются с результатами
теоретических расчетов (см. рис. 3).
М насыщение достигается за 4-5 мин, то при концентрации
6×10-6 М
– уже более часа. Очевидно, что обнаружение меньших концентраций требует еще
большего времени. Результаты эксперимента согласуются с результатами
теоретических расчетов (см. рис. 3).
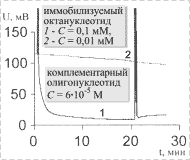
Проведены исследования кинетики процесса гибридизации в зависимости от количества иммобилизованного олигонуклеотида. Результаты исследований приведены на рис. 7.
|
|
|
|
Рис. 6. Изменение показаний сенсора при добавлении комплементарного олигонуклеотида различной концентрации к октануклеотиду, иммобилизованному на поверхность стеклянной призмы |
Рис. 7. Изменение показаний сенсора при добавлении комплементарного олигонуклеотида к октануклеотиду, иммобилизованному на поверхность стеклянной призмы |
Кривая 1 соответствует случаю,
когда концентрация олигонуклеотида в растворе
составляла 0,1 мМ; кривая 2 – 0,01 мМ. Поверхностная плотность
иммобилизованных октануклеотидов составляла
соответственно 7 и 0,7 пмоль/мм2. В обоих случаях концентрация комплементарного олигонуклеотида
была 6×10-5 М.
На рис. 8 приведена кривая кинетики гибридизации для случая, когда
концентрация иммобилизуемого олигонуклеотида в
растворе составляла 1 мМ, что соответствовало
поверхностной плотности ~70 пмоль/мм2,
кривая гибридизации имеет ![]() -образный характер.
-образный характер.
|
|
|
Рис. 8. Изменение показаний сенсора при добавлении |
Анализ данного эксперимента в рамках предложенной физической модели структуры поверхности ДНК-чипа (см. рис. 2) позволяет сделать следующие выводы.
При плотности иммобилизованного олигонуклеотида
7 пмоль/мм2 структура
поверхности может быть представлена одним слоем, характеристика которого
соответствует параметрам переходного слоя; процесс образования комплементарных дуплексов приводит к изменению показателя
преломления переходного слоя, при толщине слоя ~100 нм изменение
показателя преломления составляет ![]() .
.
При плотности олигонуклеотида 70 пмоль/мм2 иммобилизованный слой представляется двухслойной структурой (см. рис. 2), кривая имеет сложный характер, где выделяются два параллельно протекающих процесса. Характер изменений на начальном участке кривой соответствует начальному участку кривой 1 на рис. 7, что говорит о наличии переходного слоя на поверхности. Дальнейший ход кривой соответствует более медленному процессу диффузии олигонуклеотида и образованию дуплексов внутри второго слоя. Наблюдаемый процесс диффузии связан с уменьшением показателя преломления во втором слое.
При снижении плотности иммобилизованного олигонуклеотида ниже уровня 1 пмоль/мм2 характер структуры поверхности изменяется и не может быть представлен однородным переходным слоем.
В проведенном эксперименте оптимальная плотность иммобилизованного олигонуклеотида составляла 7 пмоль/мм2. Данная плотность обеспечивает значительное изменение детектируемого сигнала и наиболее быстрое протекание процесса гибридизации, что позволяет использовать простое соотношение (7) для определения концентрации комплементарного олигонуклеотида в исходном растворе.
В общем, изменение показаний датчика зависит от различных факторов: поверхностной плотности иммобилизованного олигонуклеотида, от концентрации детектируемого ДНК фрагмента, от структуры пленки и условий формирования ее на поверхности SiO2.
Предполагается продолжить работу и исследовать возможность использования эллипсометрического датчика для гибридизационного анализа протяженных фрагментов ДНК, а также для детекции образований мисматчей. Разрабатывается следующая модель сенсора, позволяющая проводить измерения на линейке ДНК-чипов.
| Наверх |